短周期元素A、B、C、D中,0.5 mol A元素的离子得到6.02×1023个电子后被还原为中性原子,0.4 克A的氧化物恰好与100 mL 0.2 mol·L-1的盐酸完全反应,A元素原子核内质子数与中子数相等;B元素原子核外电子数比A元素原子核外电子数多1;C-离子核外电子层数比A元素的离子核外电子层数多1;D元素原子最外层电子数是次外层的2倍。请完成下列问题:
(1)推断A、B、C、D四种元素的符号:
A_______________;B_______________;C_______________;D_______________。
(2)C的原子结构示意图____________________________。
(3)D元素的最高价氧化物的结构式是________________。
(4)C、D元素组成的物质,分子内含有____________(填“极性”或“非极性”)键,其分子为______________(填“极性”或“非极性”)分子。
(5)用电子式表示A、C两元素形成化合物的过程:____________________________。
(1)Mg Al Cl C
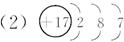
(3)O==C==O
(4)极性 非极性
(5)
由0.5 mol A元素的离子得到6.02×1023个电子(1 mol e-)后被还原为中性原子,知A元素的化合价为+2;由AO+2HCl====ACl2+H2O,知0.4 g AO的物质的量n="0.2" mol·L-1×0.1 L÷2="0.01" mol,所以AO的摩尔质量为0.4 g/0.01 mol="40" g·mol-1;而A原子核内质子数与中子数相等,故A为Mg元素。B元素原子核外电子数比Mg原子核外电子数多1,所以B是Al元素。C-核外电子层数比Mg2+核外电子层数多1,则C是Cl元素。D元素原子最外层电子数是次外层的2倍,D是C元素。