物质A—E都是由下表中的离子组成的,常温下各物质从l mL稀释到1000 mL,pH的变化如图l所示,其中A与D反应得到E。请回答:
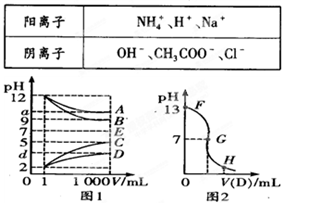
(1)根据图1中各物质的pH变化关系,写出下列物质的化学式:B. ,D. 。
(2)图l中a>9的理由是 。
(3)另取浓度为C1的B溶液25 ml,向其中逐滴滴加0.2 mol/L的D溶液,滴定过程中溶液pH的变化曲线如图2所示。
①C1为 。
②G点溶液呈中性,则加入D溶液的体积V (填“>”、“<’’或“=”)12.5 mL;
③常温下B、C溶液的pH分别是a、b且a+b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比VB:VC= 。
(1)NaOH CH3COOH
(2)A是氨水,稀释时,平衡向电离的方向移动,溶液中OH‾的浓度没有下降到原来的千分之一
(3)①0.1mol•L‾1 ② > ③10:1
题目分析:(1)根据图象知A、B是碱,C、D是酸,稀释后A、D的pH变化小于3,B、C的pH变化等于3,则A是弱碱、B是强碱,C是强酸,D是弱酸,根据离子知,A是氨水、B是氢氧化钠、C是盐酸、D是醋酸。
(2)NH3•H2O为弱碱,存在电离平衡,加水稀释促进一水合氨电离,导致溶液中氢氧根离子浓度大于原来的千分之一。
(3)①根据图2可知NaOH溶液的pH为13,c(NaOH)=10−14÷10−13=0.1mol•L‾1
②醋酸钠是强碱弱酸盐,其溶液呈碱性,要使醋酸和氢氧化钠混合溶液呈中性,则醋酸应该稍微过量,所以V>12.5mL。
③NaOH与HCl恰好完全反应,则VB•(10−14÷10−a)= VC•10−b,可得VB•:VC =1014-a-b=10:1
