金属材料在人类社会中的使用历史悠久、领域广泛.
(1)在金属活动性顺序中,______和______(填名称或化学式均可)的活动性比Cu强、比Fe弱.
(2)下表是某金属的部分物理性质:
| 颜色状态 | 硬度 | 密度 | 熔点 | 导电性 | 导热性 | 延展性 |
| 银白色固体 | 软 | 7.9g/cm3 | 1525℃ | 良好 | 良好 | 良好 |
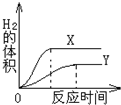
(3)等质量的两种金属(化学式分别为“X”和“A”),分别与足量盐酸反应(除了金属种类不同,其它所有条件均相同;两种金属在化合物中均显+2价),生成的H2体积与反应时间的关系如图所示.
①写出金属X与盐酸反应的化学方程式______.
②这两种金属的活动性强弱顺序为______.
③这两种金属的相对原子质量大小关系为______.
(1)在金属活动性顺序中,金属活动性比铁弱但比铜强的是锡和铅.故填:锡,铅;
(2)因金属X在良好的导热性,故可用来制作锅,因金属X在良好延展性,可加工成丝、加工成片,因金属X在良好的导电性,可用来作导线,合理即可;
(3)①金属X与盐酸反应生成氢气和盐,且X的化合价为+2价,所以金属X与盐酸反应的化学方程式为:X+2HCl=XCl2+H2↑;
②由“生成的H2体积与反应时间的关系”图可知,金属X与酸反应速率大于Y,则金属X的活动性比Y强,故填:>;
③由“生成的H2体积与反应时间的关系”图可知,金属完全反应后X放出氢气质量大于金属Y;根据金属与酸完全反应放出氢气质量=
×金属的质量,可知质量相等且同为+2价的金属X、Y完全反应后放出氢气的质量多少与金属的相对原子质量成反比;所以可以推断金属X相对原子质量小于Y,故填:<.金属的化合价数值 金属的相对原子质量
故答案为:(1)锡、铅;(2)做锅、加工成片;(3)①X+2HCl=XCl2+H2↑;②>;③<.
