学过金属的活动性顺序以后,东东对其一系列知识进行了研究.
(1)据下图中的实验现象判断,稀硫酸里a、b、c、d四种金属中,位于氢后面的金属是______.
(2)查阅资料:金属在活动性顺序里的位置越靠后,其化合物越不稳定,所以它的氧化物越易被还原.在下列①、②中各写一个化学方程式,③中写出还原金属氧化物的方法.
把金属氧化物还原成金属的三种主要方法:
①金属氧化物加热分______;
②用碳还原金属氧化物:______;
③______:3Fe3O4+8Al
4Al2O3+9Fe. 高温 .
(3)查阅资料:在金属活动性顺序里,位于氢后面的金属铜在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与浓硫酸反应,其反应的方程式为:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O反应生成的SO2是一种无色、能溶于水、有刺激性气味的气体.若用该方法制取硫酸铜,应用______溶液将生成的SO2吸收,其目的是______.
(4)请你利用所学知识设计一种以铜、稀硫酸为原料制取硫酸铜的方法.
答:______
(5)向12.7g铜中加入50g浓硫酸溶液,恰好完全反应,计算生成SO2的质量(方程式见上)和反应前硫酸溶液中溶质的质量分数.
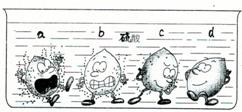
(1)图示中金属d表面无气泡,说明金属d不能与稀硫酸发生反应,则该金属在活动性顺序表中处于H之后;
故选D;
(2)①在初中化学中接触到的能受热分解的金属氧化物只有氧化汞,氧化汞受热分解为汞和氧气;
故答案为:2HgO
2Hg+O2↑; △ .
②氧化铜、氧化铁等都是金属氧化物,木炭还原氧化铜可以生成金属铜和二氧化碳气体;
故选C+2CuO
2Cu+CO2↑; △ .
③反应的化学方程式中两种反应物分别为金属氧化物和金属单质,生成金属单质和金属氧化物,因此反应规律可总结为:用金属还原金属氧化物;
故答案为:用金属还原金属氧化物;
(3)SO2是污染空气的三种有害气体之一,不能直接排放到空气中,根据该物质能与碱溶液反应,可选择氢氧化钠溶液吸收气体二氧化硫,以防止污染空气;
故答案为:氢氧化钠;防止生成的二氧化硫污染空气;
(4)铜不能与稀硫酸反应,但铜的氧化物氧化铜却可以与稀硫酸反应生成硫酸铜,所以可以把铜灼烧得到氧化铜,然后与稀硫酸反应,即可得到硫酸铜;
故答案为:将铜在空气中灼烧使其转化为氧化铜,然后再与稀硫酸反应;
(5)设:生成SO2的质量为X,消耗H2SO4的质量为Y
Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O
63.5 196 64
12.7g y x
63.5:64=12.7g:x 解之得 x=12.8g
63.5:196=12.7g:y 解之得 y=39.2g
反应前硫酸溶液中溶质的质量分数=
×100%=78.4%39.2g 50g
答:生成SO2的质量为12.8g;反应前硫酸溶液中溶质的质量分数为78.4%.
