在容积为2L的密闭容器中,进行反应:A(g)+2B(g)C(g)+D(g)
在不同温度下,D的物质的量n(D)和时间t的关系如图所示.试回答下列问题:
(1)800℃时,0-5min内,以B的浓度变化表示的平均反应速率为______.
(2)能判断该反应达到化学平衡状态的依据是______.
a.容器中压强不变
b.混合气体中c(A)不变
c.2v正(B)=v逆(D)
d.A、B、C、D四者共存
(3)该反应的正反应为______反应(填吸热或放热);判断的理由是______.
(4)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K(要求有计算过程).
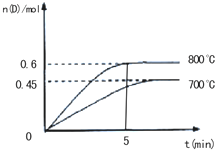
(1)由图象可知,800℃时,0-5min内D的物质的量的变化为0.6mol,则参加反应的B的物质的量为1.2mol,则v(B)=
=n V t
=0.12mol•L-1•min-1,1.2mol 2L 5min
故答案为:0.12mol•L-1•min-1;
(2)a.根据方程式可知,反应后气体的物质的量减小,压强减小,当容器中压强不变时,即是平衡状态,故a正确;
b.混合气体中c(A)不变时,则A的正逆反应速率相等,是平衡状态,故b正确;
c.不同物质表示反应速率时,正逆反应速率之比等于化学计量数之比是平衡状态,则v正(B)=2v逆(D)是平衡状态,故c错误;
d.当反应开始后,A、B、C、D四者共存,但平衡不一定达到平衡状态,故d错误;
故答案为:ab;
(3)由图象可知,800℃时D的物质的量大于700℃时D的物质的量,说明温度越高,D的物质的量越大,则升高温度平衡正移,所以正方向为吸热方向,
故答案为:吸热;温度高,D的含量大,依据勒夏特列原理,升温有利于吸热反应;
(4)若最初加入1.0molA和2.2molB,设参加反应的A为nmol,
A(g)+2B(g)⇌C(g)+D(g)
初始的量:(mol) 1.0 2.2 0 0
反应的量:(mol) n 2n n n
平衡的量:(mol)1-n 2.2-2n nn
由图象可知平衡时D的物质的量为0.6mol,即n=0.6mol,则平衡时c(A)=
=0.2mol/L,c(B)=1-n V
=0.5mol/L,2.2-2n V
c(C)=c(D)=
=0.3mol/L,则K=0.6mol 2L
=1.8,0.3×0.3 0.2×0.52
答:800℃时的平衡常数K为1.8.
