(6分)下表是元素周期表的一部分,表中所列字母分别代表某一化学元素。

(1)i是铁元素,其原子的最外层电子数为2,请写出铁元素的原子结构示意图___________。
(2)由以上元素形成的金属单质中,熔点最低的是___________________。
(3)NH3·H2O的电离方程式为NH3·H2O
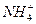 +OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______________________。
+OH-,试判断NH3溶于水后,形成的NH3·H2O的合理结构是______________________。
(4)1906年的诺贝尔化学奖授予为制备F2单质作出重要贡献的化学家莫瓦桑,请预测首先被用来与F2反应制备稀有气体化合物的元素是_________________________。(填写字母)
(5)利用稀有气体化合物,人们实现了许多制备实验上的突破。如用XeO3在碱性条件下与NaBrO3反应生成NaBrO4,同时放出Xe。写出上述反应方程式:_____________________。
(1)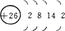
(2)Na (3)b(4)j
(5)XeO3+3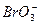 ====3
====3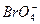 +Xe
+Xe
本题考查的是周期表的有关知识及化学常识。
(1)铁的原子序数为26,其最外层有2个电子,则倒数第二层电子数为26-(2+8)-2=14;
(2)同主族元素从上到下金属性增强;同周期从左至右金属性减弱。故短周期中位于左下角的钠元素的金属性最强,其熔点最低;
(3)由电离方程式知,水分子中的H—O键断裂,NH3结合H+形成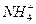 ,故选(b)。
,故选(b)。
(4)Xe的原子半径最大,相对而言在稀有气体原子中最易与F2化合;
(5)XeO3中的Xe化合价为+6,故利用化合价升降法可配平该方程式。
