人类的生活离不开金属,用我们学到的化学知识和方法能分析和解释许多现象.
(1)常见的三种金属被发现、使用的先后顺序依次为:铜、铁、铝.金属大规模被使用的先后顺序跟下列______(填序号,下同)选项关系最大.
①地壳中金属元素的含量 ②金属的导电性 ③金属的活动性
(2)下面是甲、乙、丙、丁四种常见金属与盐酸反应的比较示意图.以下说法错误的是______.

①可将上述四种金属分为两类:一类能与盐酸反应,一类不能与盐酸反应
②金属甲、乙、丙与盐酸的反应属于置换反应
③若乙是金属Zn,则丙可能是Fe或Cu
④四种金属的活动性强弱顺序为:甲>乙>丙>丁
(3)颗粒达到纳米级的单质铁具有很强的反应活性,俗称“纳米铁”.实验室制备的方法是:以高纯氮气作保护气,在高温条件下用H2和FeCl2发生置换反应,生成“纳米铁”,其化学方程式为______,反应中需要保护气的原因是______.
(4)向一定量的铁粉中逐滴加入稀硫酸至过量,如图是反应过程中某种物质的质量Y随加入稀硫酸的质量变化的关系,则Y不可能表示______.
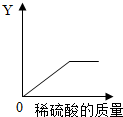
①消耗铁粉的质量 ②生成硫酸亚铁的质量 ③溶液的总质量 ④生成氢气的质量
(5)印刷铜制电路板的“腐蚀液”为FeCl3溶液.已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2.现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体,关于烧杯中物质组成的说法正确的是______.
①溶液中一定含FeCl3,固体一定是铁和铜 ②溶液中一定含FeCl2,固体一定含铜
③溶液中一定含FeCl2、CuCl2,固体一定含铜 ④溶液中一定含FeCl2,固体一定是铁和铜.
(1)由题可知地壳里含量最高的是金属铝,但铝开发利用的时间在后,说明金属大规模开发、利用的先后顺序与地壳里金属含量无关,同时与金属的导电性和延展性也无关,而是与金属活动性顺序和金属冶炼的难易程度有关;
(2)由题意可知四种金属的活动性强弱顺序为:甲>乙>丙>(H)>丁,因此丙不可能为铜;
(3)反应物为氢气和氯化亚铁,生成物是铁和氯化氢,反应的化学方程式为H2+FeCl2
2HCl+Fe,纳米铁在高温下与空气中的氧气发生反应,因此反应中需要保护气; 高温 .
(4)向一定量的铁粉中逐滴加入稀硫酸至过量,消耗铁粉的质量、生成硫酸亚铁的质量、生成氢气的质量都是先增加,随着铁粉的反应完全它们的质量不再增加;溶液的总质量是不断增加的;
(5)铜、铁均能与FeCl3溶液反应,充分反应后烧杯中仍有少量固体,说明FeCl3不再存在,溶液中一定含FeCl2;铁能与氯化铜溶液反应,因此溶液中可能没有氯化铜,铁不剩余;
故答案为(1)③;
(2)③;
(3)H2+FeCl2
2HCl+Fe;防止生成的纳米铁在高温下与空气中的氧气发生反应 高温 .
(4)③
(5)②
