有A、B、C三种元素,已知5.75 g A单质跟盐酸完全反应,在标准状况下可产生2.8 L氢气和0.25 mol ACln;B的气态氢化物的分子式为H2B,其相对分子质量与B的最高价氧化物的水化物相对分子质量之比为1∶2.88,B核内质子数与中子数相等;C和B可以形成CB2型液态化合物,并能溶解B的单质,试完成下列问题:
(1)试通过计算推断A、B、C各是什么元素?
(2)写出A、B的离子结构示意图,B在周期表中的位置,CB2的化学式。
(3)用电子式表示Ca和B形成化合物的过程。
(1)A:Na B:S C:C
(2) 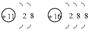 B在第3周期ⅥA族CB2为:CS2
B在第3周期ⅥA族CB2为:CS2
(3)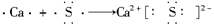
依A与盐酸反应放出氢气的有关量通过计算讨论推知A;依B的氢化物与氧化物的水化物相对分子质量之比计算B的相对原子质量,进而推知B;依有关性质推知C。
解:(1)2A+2nHCl 2ACln+nH2↑
2ACln+nH2↑
2Ag 2 mol 22.4n L
5.75g 0.25 mol 2.8 L
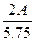 =
=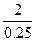
A=23
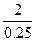 =
=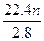
n=1,则A为钠。
B的气态氢化物为H2B,则其最高价氧化物的水化物为H2BO4,有
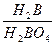 =
=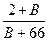 =
=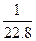
B=32
由B核内质子数与中子数相等,知B的质子数为16,B为硫。
C与B可以形成CB2型液态化合物,并能溶解B的单质,则CB2为CS2,C为碳。
