(9分)将主族元素X的最高价氧化物X2O 4.7 g溶于95.3 g水中,所得溶液中溶质的质量分数为5.6%。Y与X在周期表中位于同一主族,Y的氢氧化物12 g与400 mL 0.75 moL·L-1的盐酸恰好中和。Z与Y在周期表中位于同一周期,标准状况下5.6 L ZO2气体的质量为16 g。求X、Y、Z的相对原子质量。并分别写出它们原子的电子式。
X、Y、Z的相对原子质量分别为:39,23,32,电子式分别为K·,Na·,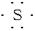 。
。
设X的相对原子质量为M(X),Y的相对原子质量为M(Y)。
由 X2O+H2O====2XOH
2M(X)+16 2×[M(X)+17]
47 g (4.7+95.3)×5.6% g
即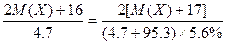 ,M(X)=39,X为钾元素;
,M(X)=39,X为钾元素;
又已知n(HCl)="0.75" mol·L-1×0.40 L="0.30" mol则
YOH+HCl====YCl+H2O
M(Y)+17 1 mol
12 g 0.30 mol
∴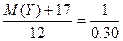 ,M(Y)=23,Y为钠元素;
,M(Y)=23,Y为钠元素;
ZO2的摩尔质量为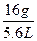 ×22.4 L·mol-1="64" g·mol-1,即ZO2相对分子质量为64,M(Z)="64-16×2" =32,Z为硫元素。则X的相对原子质量为39,电子式为K·;Y的相对原子质量为23,电子式为Na·;Z的相对原子质量为32,电子式为
×22.4 L·mol-1="64" g·mol-1,即ZO2相对分子质量为64,M(Z)="64-16×2" =32,Z为硫元素。则X的相对原子质量为39,电子式为K·;Y的相对原子质量为23,电子式为Na·;Z的相对原子质量为32,电子式为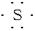 。
。
