氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:
N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1.
(1)实验室中常用来制备氨气的化学方程式为______.
(2)已知H2(g)的燃烧热为285.8kJ•mol-1,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式______.
(3)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将______(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为______mol•L-1.(25℃时,NH3•H2O的电离平衡常数Kb≈2×10-5).
(4)工业上常用CO2和NH3通过如下反应合成尿素[CO(NH2)2].
CO2(g)+2NH3(g)
CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10mol CO2和0.40mol NH3,70min开始达到平衡.反应中CO2(g)的物质的量随时间变化如下表所示:一定条件
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
②在100min时,保持其它条件不变,再向容器中充入0.050mol CO2和0.20mol NH3,重新建立平衡后CO2的转化率与原平衡相比将______(填“增大”、“不变”或“减小”).
③根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变,则(t+10)℃下正确的图象可能是______(填图甲中的“A”或“B”).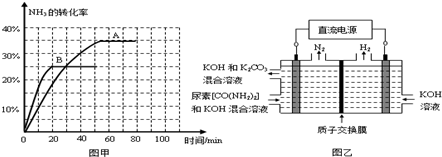
④图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素[CO(NH2)2]的碱性溶液制取氢气.该装置中阳极的电极反应式为______,若两极共收集到气体22.4L(标况),则消耗的尿素为______g(忽略气体的溶解).
(1)实验室制备氨气的方法是加热氯化铵和熟石灰的固体混合物,方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,△ .
故答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;△ .
(2)NH3(g)在纯氧中燃烧生成无毒、无害物质量氮气,的热化学方程式,实际上是考查盖斯定律的应用,根据H2(g)的燃烧热为285.8kJ•mol-1,即H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ•mol-1…①,再结合已知的:N2(g)+3H2(g)⇌2NH3(g)△H=-92.4kJ•mol-1…②
(①×3-②)×2即可得到:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530kJ•mol-1,
故答案为:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=-1530kJ•mol-1;
(3)①向(NH4)2SO4溶液中滴加稀氨水的过程中水的电离平衡受到抑制,H2O⇌H++OH-,加入酸和碱平衡逆向移动,因此加氨水对水的电离起逆向移动;由amol(NH4)2SO4溶于水,向该溶液中滴加VL稀氨水后溶液呈中性可知,c(OH-)=10-7mol/L,设平衡时NH3•H2O的物质的量为x,溶液的体积为b,
则:NH3•H2O⇌NH4++OH-
x/b 2a/b10-7
由电离平衡常数可知:
=2×10-5解之得:x=a/100,则c(NH3•H2O)=a/100V,
×10-72a b x b
故答案为:逆向;a/100V;
(4)①从表中的数据可知:80min时已经达到平衡,v逆(H2O)=v正(H2O)=v正(CO2),而20min时未达到平衡,v正(CO2)大于80min时v正(CO2),因此:20min时v正(CO2)大于80min时v逆(H2O),
故答案为:>;
②第一次投料是0.10molCO2和0.40molNH3,第二次投料是0.15molCO2和0.60molNH3,第二次投料建立的平衡状态相当于再第一次投料建立平衡的基础上再加压,平衡正向移动,因此CO2的转化率将增大,故答案为:增大;
③利用三段式计算出30min时NH3的转化率为20%,70min时NH3的转化率为30%,然后模仿已有曲线绘制出曲线,注意70min前的图象不能画成直线,无论是吸热还是放热反应,温度升高时,达到平衡的时间都会缩短;该反应是放热反应,温度升高,平衡会逆向移动,所以NH3的转化率会减小,故答案为:B;
④电极反应式为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O,总反应:CO(NH2)2+2OH-=CO32-+N2↑+3H2↑
即 1molCO(NH2)2 ~4mol气体,
60g89.6L
15g22.4L,
故答案为:CO(NH2)2-6e-+8OH-=CO32-+N2↑+6H2O;15.
