Dash of Hope
"Dash" is a symbol which represents every day we’ve spent alive on earth.Therefore, how you spend your "dash" is important.
Recently I
36 about a little girl named Hope.After learning more about her life, I couldn’t help but feel it was not by
37 , nor happenstance, that she had been named "Hope".The strong feeling of sympathy and generosity
38 in her young heart made a lasting impression on me and countless others.
39 I never had the opportunity to meet her, I wish I had.It seems as though she was wise beyond her tender years and very, very special.
Hope was a twelve-year-old girl who was
40 a "wish" in early December 2010 by the "Make-A-Wish" Foundation after being 41 that she had a rare type of bone cancer.However, when she found out that more than 150
42 in her area were waiting for their wishes to be granted (实现) , she unselfishly used her wish to
43 that those children have their wishes granted.She also asked tW it be done
44 January 16, 2011.Unfortunately, however, the organization informed her that her
45 request could not be granted as the funds (资金) were simply
46 .They calculated that they would need to raise more than one
47 dollars in thirty days in order to grant her wish.
48 , but not discouraged, she turned her disappointment into an enthusiasm that inspired caring
49 to take up helping grant the wishes of the other children, and eventually
50 as well.Newspaper columnists and reporters for radio and TV stations
51 the story of this caring young girl who had
52 the hearts of so many and as word spread, the community was challenged.Committees were fanned and schools, corporations and various organizations assisted in
53 money to help make Hope’s dream come true.
Her efforts were not in vain as they continue to help others, not only
54 , but spiritually and emotionally as well.At the gathering to celebrate her life, "A Celebration of Hope" on January 16, 2011 , the
55 was made that they had indeed received donations totaling more than one million dollars.Her wish had been granted!
| 小题1: | | A.heard | B.thought | C.cared | D.talked |
|
| 小题2: | | A.coincidence | B.independence | C.convenience | D.intelligence |
|
| 小题3: | | A.lost | B.carried | C.expected | D.housed |
|
| 小题4: | | A.Until | B.Unless | C.Though | D.If |
|
| 小题5: | | A.expressed | B.offered | C.made | D.sent |
|
| 小题6: | | A.recognized | B.informed | C.reminded | D.understood |
|
| 小题7: | | A.children | B.citizens | C.villagers | D.relatives |
|
| 小题8: | | A.suggest | B.ask | C.arrange | D.order |
|
| 小题10: | | A.final | B.formal | C.simple | D.noble |
|
| 小题11: | | A.unbearable | B.unbelievable | C.unavailable | D.uncomfortable |
|
| 小题12: | | A.thousand | B.hundred | C.million | D.billion |
|
| 小题13: | | A.Disappointed | B.Surprised | C.Worried | D.Embarrassed |
|
| 小题14: | | A.committees | B.individuals | C.corporations | D.organizations |
|
| 小题15: | | A.theirs | B.ours | C.hers | D.yours |
|
| 小题16: | | A.wrote | B.read | C.broadcast | D.shared |
|
| 小题17: | | A.touched | B.examined | C.won | D.opened |
|
| 小题18: | | A.finding | B.spending | C.raising | D.borrowing |
|
| 小题19: | | A.perfectly | B.physically | C.healthily | D.thankfully |
|
| 小题20: | | A.proposal | B.decision | C.conclusion | D.announcement |
|
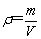
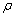 =____________。
=____________。