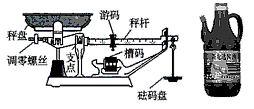
小明家开了一家小型超市,如图为超市里使用的台秤,其工作原理与天平相同。学习密度知识后,小明准备利用台秤粗测超市里卖的瓶装“新龙达”牌酱油(V=2L)的密度。
(1)【设计实验】
A.将台秤放置在水平桌面上,调节调零螺丝,使秤杆平衡;
B.用台秤称出满瓶酱油和瓶的总质量m1;
C.用台秤称出空瓶的质量m2;
D.由公式ρ=_______求出酱油的密度。请找出该方案中的一处错误并指出正确的做法:_________________________________________。
(2)【分析和论证】
小明根据修正后的实验方案完成了实验。如图甲、乙所示为实验过程中用台秤分别称量m1和m2时的槽码及游码示数,请你根据图示把下面记录数据的表格填写完整。

(3)【联系与应用】
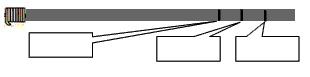
小明为了比较超市里的“新龙达”牌酱油、“金龙鱼”牌菜籽油和“农夫山泉”矿泉水的密度大小,在均匀木棍的一端绕上金属丝(目的是使木棍能竖直浮在液体中)制成简易密度计,分别放入三种液体中,在木棍与液面接触处划上横线(如图所示)。请将三条横线各自对应的液体名称填入对应的方框内。

(1)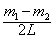 ;A中应该“先将游码置于秤杆的0刻度处,再调节秤杆平衡”;
;A中应该“先将游码置于秤杆的0刻度处,再调节秤杆平衡”;
(2)(3)“略”