TDI、MDI等精细化工使用的H2可以通过天然气来制取,其生产流程如图1:
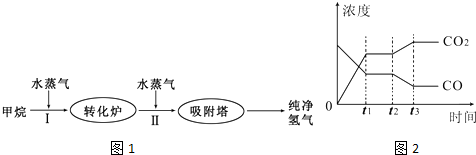
(1)此流程的第I步反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g),100℃时,将1molCH4和2molH2O(g)通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5.此时该反应的平衡常数K=______.
(2)此流程的第II步反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
(1)100℃时,将1molCH4和2molH2O通入容积为100L的恒容密闭容器中,达到平衡时CH4的转化率为0.5,
CH4(g)+H2O(g)⇌CO(g)+3H2(g)
起始量(mol/L) 0.01 0.02 0 0
变化量(mol/L) 0.0050.005 0.005 0.015
平衡量(mol/L) 0.005 0.015 0.005 0.015
化学平衡常数K=
=c(CO).c3(H2) c(CH4).c(H2O)
=2.25×10-4 ,故答案为:2.25×10-4 ;0.005×(0.015)3 0.005×0.015
(2)随着温度的升高,化学平衡常数减小,说明平衡向逆反应方向移动,则正反应是放热反应;
设CO的转化率为x,
CO(g)+H2O(g)⇌CO2(g)+H2(g)
起始0.02mol/L 0.02mol/L 00
反应0.02xmol/L 0.02xmol/L 0.02xmol/L0.02xmol/L
平衡0.02(1-x)mol/L0.02(1-x)mol/L 0.02xmol/L 0.02xmol/L
化学平衡常数K=
=9,x=75%;0.02x×0.02x [0.02×(1-x)]2
在t2时刻CO的浓度减小、CO2浓度增大,平衡向正反应方向移动,且CO和CO2浓度变化有接触点,所以可以通过改变降低温度、增大水蒸气的量或减少氢气的量实现,
故答案为:放热;75%;降低温度或增加水蒸气的量或减少氢气的量.
