在500°C、常压下,将2mol SO2和1mol02放入一个体积可变的密闭容器中,测得容器的起始容积为200L.经一段时间后反应达到平衡,混合气体的体积变为140L,请回答下列问题:
(1)SO2的转化率为______.如果向平衡混合气中充入N 2,SO2的转化率如何变化?______.
(2)若起始时加入amolSO2、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,测得混合气体的容积为210L.则 a=______,容器的起始容积为______SO3的体积分数为______
(3)若将密闭容器体积固定为200L,起始时加入xmolSO2、y mol O2和z mol SO3,反应达平衡时,温度、压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,则x、y应该满足的关系式为______,x、z应该满足的关系式为______.
(1)反应方程式为2SO2+O2
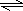
2SO3,利用三段式计算,
2SO2+O2
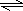
2SO3
起始:2mol 1mol 0
转化:2x x 2x
平衡:2-2x 1-x 2x
根据体积之比等于物质的量之比可知:(2-2x+1-x+2x):3=140:200,解之得x=0.9,所以SO2的转化率为
×100%=90%,如果向平衡混合气中充入N 2,压强不变,体积增大,平衡向逆反应方向移动,则SO2的转化率降低,故答案为:90%;降低(或减小);0.9×2 2
(2)起始时加入amolS02、b mol O2,且a:b=2:l,在同样温度和压强下,反应达到平衡时,与(1)平衡状态相同,为等效平衡,物质的转化率和百分含量都相同,设起始体积为V,则
=V 200L
,解之得V=300L,SO3的体积分数为与(1)相同,为210 140
×100%=2x (2-2x+1-x+2x)
×100&=1.8 3-0.9
×100%=85.7%,6 7
故答案为:3; 300 L;85.7%(或
);6 7
(3)若将密闭容器体积固定为200L,起始时加入xmolS02、y mol 02和z mol SO3,反应达平衡时,温度、压强与(2)完全相同,容器内各气体的体积分数也与(2)达平衡时的情况完全相同,为等效平衡,则有x=2y,且相当于只加二氧化硫和氧气时,起始时二氧化硫的物质的量(设为n)应为
=n 2
,n=200 140
,即x+z=20 7
,20 7
故答案为:x=2y; x+z=
.20 7
