黄铁矿(FeS2,其中S为-1价)是工业生产硫酸的重要原料.FeS2在高温下与氧气反应:3FeS2+8O2
6SO2+Fe3O4高温 .
(1)若有1mol FeS2参加反应,转移电子的物质的量为______.
(2)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)
2SO3(g)△H.催化剂 .
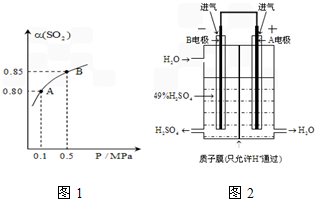
已知T℃时,SO2的平衡转化率(α)与体系总压强(P)的关系如图.根据图回答下列问题:
①T℃时,将2.0mol SO2和1.0mol O2置于10L密闭恒容反应器中,反应达平衡后,体系总压强为0.10MPa,计算该反应的平衡常数(写出计算过程,计算结果保留两位有效数字):______.
②T℃时,平衡由A点变到B点时,平衡常数K(A)______K(B)(填“>”、“<”或“=”).
③已知1g二氧化硫完全反应生成气态三氧化硫,放出热量1.536kJ,则上述反应的反应热△H=______.(保留小数点后一位)
(3)某科研小组利用原电池原理,用SO2、O2和H2O来制备硫酸,装置如图,电极A、B为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触.请问:
①B电极的电极反应为______;
②溶液中H+的移动方向是由______极池到______极池(填A、B).
(1)3FeS2+8O2
6SO2+Fe3O4中,Fe、S元素的化合价升高,O元素的化合价降低,3mol FeS2参加反应,由O元素的化合价变化可知,转移的电子为8mol×2×(2-0)=32mol,则1molFeS2参加反应转移的电子的物质的量为:高温 .
≈10.7mol,32mol 3
故答案为:10.7mol;
(2)①由图1可知:体系总压强为0.10MPa,α(SO2)=0.8,则:
2SO2(g)+O2(g)
2SO3(g)催化剂 . △
起始浓度:0.200.100.0mol•L-1
转化浓度:0.160.080.16mol•L-1
平衡浓度:0.040.020.16mol•L-1
K=
=c(SO3)2 c(SO2)2•c(O2)
=8.0×102,0.162 0.042×0.02
故答案为:8.0×102;
②T℃时,平衡由A点变到B点时,温度不变,所以化学平衡常数不变,即K(A)=K(B),故答案为:=
③2mol二氧化硫的质量为128g,完全燃烧128g二氧化硫生成气态三氧化硫放出的热量为:1.536kJ/g×128g≈196.6kJ,所以反应2SO2(g)+O2(g)
2SO3(g)的反应热△H=-196.6kJ•mol-1,催化剂 .
故答案为:-196.6kJ•mol-1;
(3)①该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,正极上投放的气体是氧气,正极上氧气得电子和氢离子反应生成水,根据硫酸和水的出口方向知,B极是负极,A极是正极,所以B极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,原电池放电时,氢离子由负极B移向正极A,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②原电池放电时,氢离子移动方向与正极移动,所以溶液中氢离子由负极B移向正极A,
故答案为:B;A.
