Ⅰ某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图1所示,由图中数据分析求:
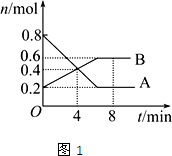
(1)该反应的化学方程式为______.
(2)反应开始至4min时,A的平均反应速率为______.
(3)第4min末时A、B的物质的量浓度依次为______、______.
第4min时,正、逆反应速率的大小关系为:v(正)______v(逆)(填“>”、“<”或“=”,同),第8min时,v(正)______v(逆).
Ⅱ有铜片、锌片和250mL稀硫酸组成的原电池,当在铜片上放出4.48L(标准状况下)的气体时,硫酸恰好完全反应.
(1)该原电池的正极反应式______
(2)原稀硫酸的物质的量浓度是______mol/L
(3)锌片减少的质量______g.
Ⅰ.(1)由图可知,A减少,B增加,则A为反应物,B为生成物,相同时间内△n之比等于化学计量数之比,等于(0.8-0.2):(0.6-0.2)=3:2,所以该反应为3A 2B,故答案为:3A
2B,故答案为:3A 2B;
2B;
(2)反应开始至4min时,A减少0.8mol-0.4mol=0.4mol,v=
=△c △t
=0.05mol/(L•min),故答案为:0.05mol/(L•min);0.4mol 2L 4min
(3)4min末时A、B的物质的量均为0.4mol,c(A)=c(B)=
=0.2mol/L,第4min时向正反应方向进行,所以v(正)>v(逆),第8min时反应达到平衡,所以v(正)=v(逆),故答案为:0.2mol/L;0.2mol/L;>;=;0.4mol 2L
Ⅱ.(1)正极上氢离子得到电子,正极反应为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(2)铜片上放出4.48L,n(H2)=n(H2SO4)=
=0.2mol,c=4.48L 22.4L/mol
=n V
=0.8mol/L,故答案为:0.8;0.2mol 0.25L
(3)由Zn~H2↑可知,溶解的Zn为0.2mol×65g/mol=13g,故答案为:13.
