问题
实验题
某课外小组在研究金属与酸的化学反应时,设计了以下三个实验。
(1)不同金属与酸反应的速率不同。
取质量相等的铁片和锌片,分别放入溶质质量分数相同的足量稀盐酸中,生成氢气的质量(m)与反应时间(t)的关系曲线如下图所示。
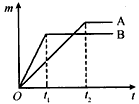
①锌比铁的金属活动性____。(填“强”或“弱”)
②B表示的金属是____,请写出金属B与稀盐酸反应的化学方程式___________________。
(2)同种金属与不同质量分数的盐酸反应的速率不同。
取质量相等的锌片,分别放入5%、20%的足量稀盐酸中。实验表明,盐酸浓度越大,反应速率越快。5% 的盐酸与锌片反应生成H2的质量(m)与反应时间(t)的关系曲线如下图所示。请在该图上用虚线“-----”补画出20%的盐酸与锌片反应时,m与t的关系曲线。
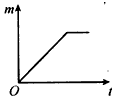
(3)温度对金属与盐酸的反应速率也有影响。
实验表明,温度越高,盐酸与金属反应的速率越快。请你设计一个实验方案证明这一结论。你的方案是_________________________________________。
答案
(1)①强;②锌(或Zn);Zn+2HCl==ZnCl2+H2↑
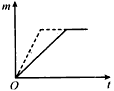
(2)
(3)取两个烧杯,分别加入等质量的同种金属,再分别加入质量相等的足量的溶质质量分数相同的稀盐酸,对其中一个烧杯加热。可以观察到温度越高,盐酸与金属反应的速率越快。(答案合理即可)
