为测定某NaCl、Na2CO3固体混合物的组成,小明同学取16g该混合物样品放入烧杯中,称得烧杯及所盛固体混合物的总质量为98g,再把100g稀盐酸分四次平均分成四份依次加入盛有固体样品的烧杯中,每次都充分反应.实验数据如:
| 加入稀盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 烧杯及反应后混合物的总质量/g | 121.4 | 144.8 | 168.6 | 193.6 |

(1)第一次加入稀盐酸充分反应后,生成二氧化碳的质量是______g.
(2)该固体混合物中碳酸钠的质量分数?
(3)根据实验数据,在右边的坐标纸上绘制出所加稀盐酸质量与生成气体质量关系的曲线(不要求写出计算过程,只画出曲线即可)
(1)设:样品中碳酸钠的质量分数为X;
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
16g×X 4.4g
列比例求出X=66.25%
(2)每25g的稀盐酸与足量的样品反应生成二氧化碳1.6g,生成4.4g的二氧化碳所需稀盐酸的质量为Y;
列比例:1.6g/25g=4.4g/Y
解得Y=68.8g
(3)如图红线所示:根据计算68.8g的稀盐酸与碳酸钠恰好完全反应生成4.4g的二氧化碳,当加入稀盐酸超过68.8g后,碳酸钠已经完全反应,二氧化碳气体的质量不再变化.
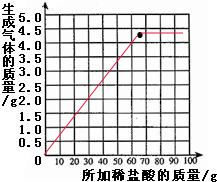
故答案为:(1)1.6g
(2)66.25%
(3)见图红线部分.

