(13分)下表列出了部分常见含有10电子和18电子的粒子,回答下列问题。
| 10电子粒子 | CH4、NH3、H2O、HF、Na+、Al3+、NH4 +、OH- |
| 18电子粒子 | H2S、HCl、K+ 、Cl-、C2H6 …… |
(1)表中-1价的简单离子在周期表中的位置是 (周期、族)。其单质有毒,常用强碱溶液吸收,反应的离子方程式为
(2)表中水溶液显碱性的分子的电子式是
写出其催化氧化的化学方程式
(3)写出由表中两种10电子粒子相互反应,生成两种10电子粒子的离子方程式
。
(4)表中在水溶液中能够促进水电离的粒子有
(5)由表中离子组成的NaOH是常用的试剂,下图是配置一定物质的量浓度的氢氧化钠溶液的操作图示,整个过程分为①②③④⑤⑥六个单元。
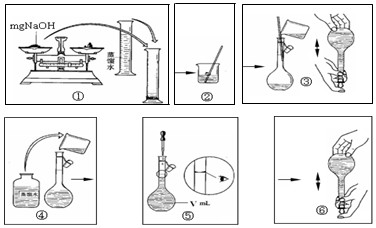
其中操作有错误的单元有(选填①②……)
(6)由第二周期元素形成的氢化物A和B都含有18电子, A是一种6原子分子,可做火箭发动机的燃料,B是一种常见强氧化剂。已知16g液态A与液态B充分反应生成一种液态10电子分子和一种气态单质,并放出838 kJ热量。写出A与B反应的热化学方程式
(13分)
(1)(3分,其中方程式2分,下同) 第三周期ⅦA Cl2+2OH-==Cl-+ClO-+H2O
(2)(3分) NH3电子式略 4NH3+5O2==4NO↑+6H2O
(3)(2分) NH4 + + H2O="=" NH3↑ + H2O
(4)(1分,只答对一个不给分) Al3+、NH4 +
(5)(2分,其中答对两个给1分,错答不给分)①③④⑤
(6)(2分)N2H4(l) + 2H2O2(l) = 4H2O(l) + N2(g) ΔH=﹣1676kJ/m
