(13分)现有下列短周期元素性质的相关数据:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 原子半径(10-10m) | 1.30 | 0.82 | 0.99 | 1.11 | 0.90 | 1.18 |
| 最高或最低化合价 | +2 | +3 | +7 | +4 | +2 | +3 |
| -1 | -4 |
(1)②和③形成的化合物类型为 (填“离子”或“共价”)化合物;
(2)元素①的金属性比元素⑥要 (填“强”或“弱”),试从原子结构方面解释其原因: ;
(3)在自然界中,元素④的存在形态为 ,工业上粗制该元素单质的化学方程式为 ;
(4)⑥的单质与浓NaOH溶液反应的离子方程式是 ;
(5)实验室现有元素①的单质和某未知金属单质M,请简要写出比较两者金属性强弱的一种实验方案 。







(1)共价(2分)
(2)强(1分);镁的原子半径大于铝(1分),原子核对最外层电子的吸引力比铝弱,比铝原子更容易失去电子(1分),所以镁元素的金属性比铝要强。
(3)化合态(1分),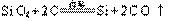 (2分)
(2分)
(4)2Al + 2OH-+ 2H2O = 2AlO2-+ 3H2↑ (2分)
(5)在两个小烧杯中分别加入适量蒸馏水(或等浓度的盐酸)(1分),然后投入形状大小相同的金属片(1分),若M反应比镁剧烈,则M的金属性比Mg强 (1分)
