问题
计算题
9.6g元素A与4.2g元素B含有相同的原子数,A和B原子核中质子数与中子数相等,已知A元素在其最高价氧化物中的含量是40%,在其氢化物中含量为94.1%。推算出A、B在周期表中的位置。(请写出计算、推理过程)
答案
解:设该氢化物为:HxA,该最高价氧化物分子式应该为:A2O8-x
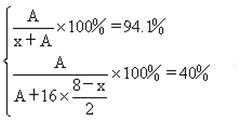

由于9.6g元素A与4.2g元素B含有相同的原子数,设B的原子量为y
A的相对原子质量是32,其中子数与质子数相等,因此质子数为16的是硫元素,在第三周期ⅥA族。
B的相对原子质量是14,其中子数与质子数相等,因此质子数为7的是氮元素,在第二周期ⅤA族。
