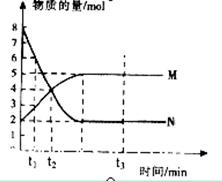
分一定温度下,在容积为VL的密闭容器中进行反应:aN(g) bM(g),N、M的物质的量随时间的变化曲线如图所示:
bM(g),N、M的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中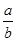 =________。
=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________。
(3)下列叙述中能说明上述反应达到平衡状态的是________。
A 反应中M与N的物质的量之比为1:1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
(6分,每空2分)(1)2;(2)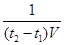 mol·L-1·min-1;(3)CEF(对2个给1分,有错不给分)
mol·L-1·min-1;(3)CEF(对2个给1分,有错不给分)
题目分析(1)从图像可知,从开始到平衡,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,故此反应的化学方程式中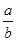 =
=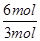 =2。
=2。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为v(M)=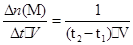 mol·L-1·min-1。
mol·L-1·min-1。
(3)A.反应中M与N的物质的量之比为1:1,是反应过程的一种状态,不能确定是否达到平衡;B.无论反应进程如何,混合气体的总质量不会变化,故B不能判断;C.若反应还在正向进行,混合气体的总物质的量减小,若总物质的量不随时间的变化而变化,则达到平衡;D.单位时间内每消耗a mol N,为正速率,同时生成b mol M,为正速率,都是正速率,不能判断;E.混合气体的总物质的量减小,混合气体的压强减小,若混合气体的压强不随时间的变化而变化,则说明已经达到平衡;F.若反应还在正向进行,N的质量分数减少,若其在混合气体中保持不变,则说明已经达到平衡。
