问题
问答题
现有足量的稀硫酸、1.3g锌片、无水硫酸铜、氧化铜和水,请从下图中选择适当仪器,设计一个简单的实验,粗略测定锌的相对原子质量.(设环境为标准状况,标准状况下氢气的密度为0.08928g/L)
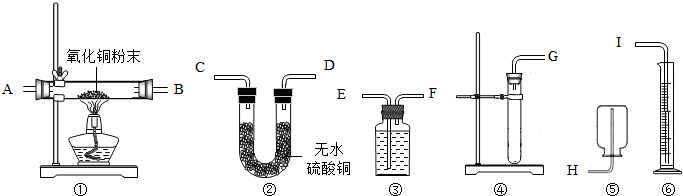
(1)应选用的装置是______.(填写装置代号)
(2)所用装置的连接顺序是______.(填写各接口的字母序号)
(3)如果实验中测得量筒中水的体积为450ml,请计算锌的相对原子质量______.
答案
(1)从提供的药品可以看出求锌的相对原子质量的关系建立在锌与硫酸的反应,并对生成的氢气的体积进行测量,进而可求出氢气的质量,利用化学方程式可求锌的原子量,该设计选择装置,图中④是制取氢气的装置,③是收集氢气并排水的装置,⑥是测量排出水的体积.
故答案为:③④⑥
(2)制取氢气的装置在前,利用③装置排水时应是气体由短管通入,水由长管排出,用⑥测量出排出水的体积进而确定收集到的氢气的体积.
故答案为:G→F→E→I
(3)水的体积即是生成氢气的体积换算出氢气的质量,利用化学方程式进行计算可求出锌的原子量.
由题意知氢气的质量为
L×0.08928g/L=0.04g450 1000
设锌的相对原子质量为 x
Zn+H2SO4=Zn SO4+H2↑
x 2
1.3g 0.04g
=x 2 1.3g 0.04g
解得,x=65
故答案为:65
