问题
选择题
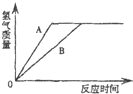
有等质量的A、B两种金属,A的相对原子质量小于B,将A放入质量分数为15%的稀硫酸中,B放入质量分数为15%的稀盐酸中,在反应中A、B均为正二价且均有剩余,产生氢气的质量随反应时间变化曲线如图.下列说法正确的是( )
A.消耗的稀硫酸和稀盐酸质量一定不相等
B.消耗B的质量一定小于A的质量
C.产生氢气的速率A<B
D.若A为Fe,则B可能为Mg
答案
A、由于得到的氢气一样多,根据元素的质量守恒可知,参加反应的稀盐酸和稀硫酸的溶质中氢元素的质量一定相等,又因这两种酸溶液中溶质的质量分数相同,从而说明参与反应的两种酸的质量一定不一样多,故A正确;
B、由于A的相对原子质量小,因此得到相同质量的氢气,参加反应的金属A的质量要少一些,故B错;
C、金属的活动性越强的,和酸溶液反应时产生气体的速率也就越快,根据图象不难看出,金属A完全反应后所需要的时间短,即A的活动性强,产生氢气的速率A>B,故C错;
D、根据图象不难看出,金属A完全反应后所需要的时间短,即A的活动性强,所以如果A为Fe,则B不可能为Mg,故D错.
故选A.
