为测定某有机化合物A的结构,进行如下实验.
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下).则该物质中各元素的原子个数比是______;
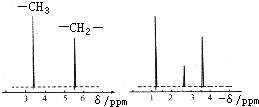
(2)质谱仪测定该有机化合物的相对分子质量为46;核磁共振氢原子光谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl-CH2一O-CH3)有两种氢原子(如图).经测定,有机物A的核磁共振氢谱示意图(如图),则A的结构简式为______.
(1)根据质量守恒定律得:化合物中所含C元素质量为:8.8g×
=2.4g,12 44
化合物中所含H元素质量为:5.4g×
=0.6g,2 18
二氧化碳和水中的氧元素质量之和为 (8.8g-2.4g)+(5.4g-0.6g)=11.2g,而 氧气的质量为
×32g/mol=9.6g,所以有机物中氧元素质量为11.2g-9.6g=1.6g,6.72L 22.4L/mol
n(C):n(H):n(O)=
:2.4 12
:0.6 1
=2:6:1,所以化合物的实验式(最简式)是C2H6O,故答案为:2:6:1;1.6 16
(2)因化合物的实验式(最简式)是C2H6O,所以分子式为(C2H6O)n,而有机化合物的相对分子质量为46,所以n=1,则分子式为:C2H6O,由核磁共振氢谱示意图可知化合物中有三种氢原子,结构简式为CH3CH2OH,故答案为:CH3CH2OH.
