(8分)水煤气不仅是合成氨的原料气也是合成烃及其化工产品的原料。
(1)直接水煤气燃料电池中,通CO、H2的极为电池的 极(选填:“正”,“负”)。
(2)水煤气变换反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
CO2(g) + H2(g) △H < 0,下列措施能提高反应速率的有 (不定项选择)。
a.升高温度 b.加入催化剂 c.增大压强 d.降低浓度
(3)H2和N2在催化剂、高温高压条件下合成氨的化学方程式为 。
(4)氨气的水溶液可用于吸收烟道气中的二氧化硫,该反应的化学方程式为 。
(5)将标准状况下582.4L合成气(已知:n(CO)∶n(H2)=4∶9)通入合成塔,一定条件下可发生2CO(g)+ 4H2(g) → CH2=CH2(g)+2H2O(g);CO(g)+3H2→CH4(g)+H2O(g),充分反应后,经测定产品中只有甲烷、乙烯和水蒸气(假定CO和H2均无剩余),试计算逸出的气体中乙烯的物质的量(列出计算过程)。
(1)负 (2)abc (3)N2 + 3H2 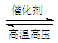 2NH3
2NH3
(4)SO2 + 2NH3 +H2O = (NH4)2SO3 [或SO2 + NH3 +H2O = NH4HSO3]
(5)依据题意:n(CO) +n(H2)=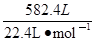 =26mol
=26mol
n(CO)=26mol×4/(4+9)=8mol,n(H2)=26mol-8mol=18mol
由方程式:2CO(g)+ 4H2(g)→C2H4(g)+2H2O(g)和CO(g)+ 3H2(g) → CH4(g)+ H2O(g)
n(CH4)+2n(C2H4)="8mol" , 3n(CH4)+4n(C2H4)=18mol,解得n(C2H4)=3mol。
题目分析:⑴在水煤气燃料电池中,还原剂CO、H2作电池的负极;
⑵通常升温、加压、增大浓度、加入催化剂等能加快反应速率;
⑶H2和N2在催化剂、高温高压条件下化合成氨:N2 + 3H2 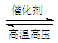 2NH3(注意该反应为可逆反应);
2NH3(注意该反应为可逆反应);
⑷氨气的水溶液吸收二氧化硫可能产生(NH4)2SO3或NH4HSO3;
⑸详见参考答案。
