问题
填空题
A、B、C、D、E、F、G、H八种元素都是前4周期元素,且原子序数依次增大。
已知:元素A的原子中没有成对电子。
元素B、C、D同周期,元素B、G同主族,且B、D、G三原子P轨道上均有2个未成对电子
元素E、F、G在同一周期,且E原子中没有未成对电子。
元素H的基态原子核外有6个未成对电子。
请回答下列问题:
(1)B、C、D三元素的电负性由大到小排列顺序为 (用元素符号表示);E、F、G三元素的原子的第一电离能由大到小排列顺序为 (用元素符号表示)。
(2)元素D与G所形成的晶体和元素D与B所形成的晶体熔沸点由高到低的顺序为 (填化学式),其原因是 。
(3)元素B与C的气态氢化物在A B中溶解性由大到小的顺序为 (填化学式),其原因是 。
B中溶解性由大到小的顺序为 (填化学式),其原因是 。
(4)B、D两元素形成的阴离子BD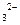 中的B的杂化类型为 ,空间结构为 ,与BD
中的B的杂化类型为 ,空间结构为 ,与BD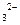 互为等电子体且含C、D两元素的微粒的化学式为 。
互为等电子体且含C、D两元素的微粒的化学式为 。
(5)A、B、C三元素各一个原子形成的分子中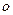 键与
键与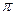 键的个数比为 ,该分子的VSERR模型 。
键的个数比为 ,该分子的VSERR模型 。
(6)元素H的基态原子的核外电子排布为 ,在周期表中处于 区。
答案

