某工厂排放的废水中含有大量的硫酸亚铁,少量的银离子以及污泥.某校兴趣小组的同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体.方案流程如下:
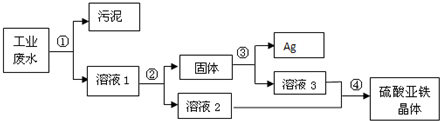
回答下列问题:
(1)步骤②中:需加入过量的物质是______,溶液2的溶质是______.
(2)步骤③中:需加入适量的物质是______(填化学式),发生反应的化学方程式是______,该反应属于______反应(选填“化合”、“分解”、“置换”或“复分解”).
(3)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?______,理由是______.
(1)步骤②为了回收银且得到硫酸亚铁溶液,应向废水中加入铁粉置换出废液中的银离子得到银,把反应后剩余固体与反应后的溶液分离,通过过滤操作得到的固体是铁粉和银粉,滤液是硫酸亚铁溶液;
(2)步骤③为把固体银中的过量铁粉除去且用所得溶液获得硫酸亚铁晶体,因此应选择加入稀硫酸与铁粉反应,反应生成硫酸亚铁和氢气;反应的方程式为:Fe+H2SO4═FeSO4+H2↑;
(3)步骤②为把废水中的银离子完全置换,需要加入过量的铁粉,因此所得到的固体并不是纯净的银,需要步骤③稀硫酸溶解铁过程才能得到纯净的银;
故答案为:(1)铁(或Fe); 硫酸亚铁(或Fe SO4);
(2)H2SO4;Fe+H2SO4═FeSO4+H2↑; 置换;
(3)否; 步骤②后所得固体含有杂质铁,不纯.
