问题
填空题
(1)将一定量的铁粉加入到的Cu(NO3)2、AgNO3混合溶液中,充分反应后过滤,请你设计实验对滤出固体中组成最复杂的情况进行验证,填写下列实验报告.
| 猜测 | 实验内容 | 实验现象 | 结论及化学方程式 |
______ | ______ | ______ | ______ |
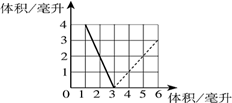
①实线部分表示剩余的气体是______;
②虚线部分表示剩余的气体是______;
③实线与虚线的交点表示的意义是______.
④反应前原有氢气______毫升.
答案
(1)根据金属活动性,铁能把银和铜从溶液中置换出来,首先置换活动性最弱的银,然后置换铜;根据加入的铁的多少,可知:
①当铁的量很少时,只能置换出少量的银,此时滤渣中只有银;
②当铁置换出银后还有剩余,就能置换出铜,此时滤渣中含有银和铜;
③当铁过量,完全置换出铜和银后还有剩余,此时滤出固体中组成最复杂,含有铜、铁、银三种金属.验证滤出固体最复杂的情况实质就是验证是否有铁存在,可用铁能与酸反应生成气体来检验.
故实验报告为:
| 猜测 | 实验内容 | 实验现象 | 结论及化学方程式 |
| 铁、铜、银的混合物 | 向滤出的固体中加入稀硫酸 | 固体部分溶解,同时有气泡产生,溶液变为浅绿色 | 加入稀硫酸有气体产生,说明固体中含有铁,固体中含有铁说明银离子、铜离子被全部置换出来,即固体中还含有铜和银,则固体为铁、铜、银的混合固体. 则化学方程式为:Fe+H2SO4═FeSO4+H2↑ |
②随着氧气的增加,氢气会完全反应,故在P点氢气就完全参加了反应,所以虚线部分表示的是没有参加反应的氧气;
③交点P表示氧气在3毫升时正好和氢气完全反应,其表示的意义是氢气和氧气在这点恰好完全反应;
④根据氢气和氧气反应时的体积比2:1,可推知原有氢气6毫升.
故答案为:①氢气;②氧气;③氢气和氧气恰好完全反应;④6.
故答案为:(1)
| 猜测 | 实验内容 | 实验现象 | 结论及化学方程式 |
| 铁、铜、银的混合物 | 向滤出的固体中加入稀硫酸 | 固体部分溶解,同时有气泡产生,溶液变为浅绿色 | 加入稀硫酸有气体产生,说明固体中含有铁,固体中含有铁说明银离子、铜离子被全部置换出来,即固体中还含有铜和银,则固体为铁、铜、银的混合固体. 则化学方程式为:Fe+H2SO4═FeSO4+H2↑ |
