金属用途广泛,其结构和性质等是化学的重要研究内容.
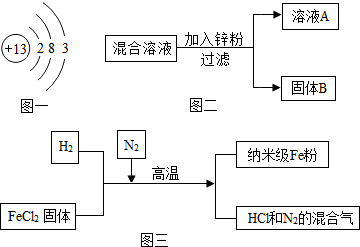
(1)如图一是铝的原子结构示意图.下列说法不正确的是______.
A.铝原子中的质子数为13
B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图二实验,并对溶液A和固体B的成分进行了分析和研究.
【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
①只有Zn(NO3)2②Zn(NO3)2、AgNO3
③Zn(NO3)2、Cu(NO3)2④Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是______(填标号),其理由是______.
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现象 | 实验结论 |
| 取少量固体B,滴加______ | 有气泡产生 | 固体B含有Cu、Ag和______ |
①纳米级Fe粉在空气中易自燃.实验中通入N2的目的是______.
②写出H2还原FeCl2,置换出铁的化学方程式______.
③研究人员发现最后制得的纳米级Fe粉样品中混有少量的FeCl2杂质.取样品20g,加入足量的盐酸,生成氢气0.7g.请计算该样品中单质Fe的质量分数(请写出计算过程)______.
(1)原子结构示意图中圆圈内数字就是质子数;所以铝原子质子数是13;由于铝原子最外层电子数是3易失去3个电子,显+3价;地壳中含量最多的元素是“氧元素”;铝做导线就是因为铝具有导电性;
(2)猜想②中无硝酸铜,说明Cu(NO3)2已与锌反应生成Cu,而铜能与硝酸银反应,所以有铜剩余时不可能存在硝酸银,也就是说只要有硝酸银时,一定也含有硝酸铜;
如果猜想①成立说明锌把硝酸银、硝酸铜都反应完了,如果能鉴别出剩余固体中含有锌,就能说明锌过量,铜和银都被它置换出来,由于锌能与酸反应产生氢气,所以向固体中加入盐酸,如果有气体产生,说明锌有剩余;
(3)①氮气化学性质稳定,在反应中起保护气的作用;因为纳米级Fe粉在空气中易自燃.所以在实验中通入N2的目的是防止生成的纳米级铁粉被氧化.
②根据“H2还原FeCl2,置换出铁”,根据质量守恒定律的元素守恒,可知另一种生成物为HCl,则其化学方程式为:H2+FeCl2
Fe+2HCl.高温 .
③由题意:取样品20g,加入足量的盐酸,生成氢气0.7g.
设Fe的质量为x.
Fe+2HCl═FeCl2+H2↑
56 2
x 0.7g
则
=56 x
,解得x=19.6g,故2 0.7g
×100%=98% 19.6g 20g
答:该样品中单质铁的质量分数为98%.
故答案为:(1)C
(2)②Zn应先与AgNO3反应,后与Cu(NO3)2反应,当有AgNO3剩余时,溶质中一定含有Cu(NO3)2
| 实验步骤 | 现象 | 实验结论 |
| 稀盐酸(或稀硫酸等) | Zn |
| ||
③该样品中单质铁的质量分数为98%.
