问题
选择题
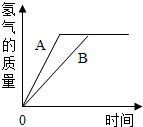
有等质量的两种金属A和B,前者放入质量分数为10%的稀硫酸中,后者放入质量分数为20%的稀盐酸中,产生氢气的质量随时间变化曲线如图所示.下列说法错误的是( )
A.产生氢气物质的量相等
B.金属的活泼性A>B
C.酸过量,金属质量不足
D.A与硫酸反应更为剧烈
答案
A、依据图象的意义可知最后生成的氢气质量相等所以氢气的物质的量一定相等;
B、质量分数10%的硫酸和质量分数20%的盐酸相比,盐酸的H+浓度要大些,A放入10%的硫酸B放入质量分数为20%的稀盐酸.产生等质量的H2,A需要的时间短,故金属活泼性A>B;
C、两种金属的质量一样多,如果酸足量,产生的氢气一定不同,现在产生的氢气质量一样,说明金属一定有一样有剩余,不能确定是否都剩余,况且没有给出两种酸的质量,因此无法判断反应时的情况;
D、由B可知,金属活泼性A>B,则A与硫酸反应更为剧烈.
故选:C
