问题
选择题
短周期元素A、B、C的原子序数依次递增,A与C同主族,C的单质在常温下是淡黄色固体,而B的单质在A的单质中燃烧也可生成淡黄色同体="则下列叙述正确的是(" )
A. B的单质在A的单质中燃烧生成的淡黄色冏体中既冇离子键又有共价键
B. A与B的简单离子半径:A<B
C. 含有A、B和C三种元尜的化合物的水溶液都呈中性
D.  与
与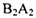 的漂白原理相同
的漂白原理相同
答案
答案:A
短周期元素中,单质固体为淡黄色的可能是S元素,而A和C同族,A可能为氧气,B在A中燃烧生成淡黄色固体,说明B可能是Na。因此:
A正确,B在A中燃烧生成Na2O2为淡黄色,Na与过氧根离子间是离子键,而过氧根离子之间的两个氧原子间是非极性共价键。
B错误,离子半径应该是B<A。
C错误,比如亚硫酸钠,水解呈碱性。
D错误,二氧化硫的漂白原理是因为结合有色色素生成无色物质,容易分解。而过氧化钠则是因为氧化有色物质。