钢铁是重要的金属材料。
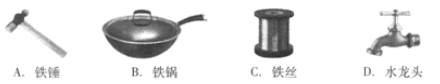
(1)下列铁制品的用途中,利用金属导热性的是___________(填字母,下同)。
(2)实验室里用一氧化碳还原氧化铁得到铁,实验过程中,先通入一氧化碳目的是 。实验中产生的尾气能否直接排放 ,为什么? 。
炼铁厂常以焦炭、赤铁矿、空气等为主要原料炼铁,反应过程如下:

写出②③两步的化学方程式 、 。
(3)某钢铁厂用下图装置测定生铁中碳的含量(假定生铁中不含有其他杂质),请你一同
参与:
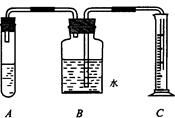
①称取生铁a g ,向A中加入 ,现象是 ,反应的化学方程式是: ;
②完全反应后量筒里的水为b L,产生氢气的密度为ρg/L,则此生铁中碳的质量分数的表达式为 。
③如果此生铁中混有少量锌,则测得结果 (填写“偏大”、“偏小”或“无影响”)
(1)B
(2)防止爆炸 ; 不能,一氧化碳有毒防止污染空气


(3)①稀盐酸(或稀硫酸),有气泡产生,Fe+2HCl=FeCl2+H2↑
②1-56ρB/2(合理答案都给分)
③偏大
③偏小
解:(1)金属铁有导电性、硬度大、导热性等性质,铁锅是利用了铁的导热性,故选B;
(2)①实验过程中,先通入一氧化碳的目的是将玻璃管内空气排干净,防止CO与空气混合遇热爆炸,同时一氧化碳有毒,如果排放到空中会造成大气污染,所以要尾气吸收;
②二氧化碳和碳在高温条件下反应能生成一氧化碳,一氧化碳和氧化铁在高温条件下反应能生成铁和二氧化碳,反应的化学方程式分别为: ,3
,3 (3)①铁的活动性比较强,能与稀盐酸反应生成氢气;
(3)①铁的活动性比较强,能与稀盐酸反应生成氢气;
②由题意可知,ag生铁完全反应后生成的氢气与量筒里的水的体积相同,也就是b L,又知道氢气的密度为ρg/L,
所以生成氢气的质量为:b×ρ=ρbg,
设ag生铁中铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x ρbg
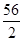 =
=
x=28ρb
故生铁中碳的质量分数为: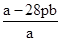 ×100%;
×100%;
③由于锌也可以和酸溶液反应生成氢气,就会使生成的气体增多,则计算出的金属的质量偏多,则生铁中的碳的质量偏小.
故答案为:
(1)B;
(2)将玻璃管内空气排干净,防止CO与空气混合遇热爆炸;不能,一氧化碳有毒防止污染空气;
 ,
, (3)①稀盐酸,有气泡产生,Fe+2HCl=FeCl2+H2↑;
(3)①稀盐酸,有气泡产生,Fe+2HCl=FeCl2+H2↑;
②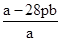 ×100%;
×100%;
③偏小.
