问题
填空题
(10分)有四种元素A、B、C、D,其中B2-离子与C+离子核外都有二个电子层,B原子的质子数与C原子的质子数之和等于D原子的质子数,A原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D的元素符号分别为 、 、 、 。
(2)B2-的电子式为 ,D原子的原子结构示意图为 ,
C+离子的结构示意图为 。
(3)写出与C+具有相同电子数的五种分子(化学式): 、 、 、
、 。
答案
(10分)
(1)A、B、C、D的元素符号分别为 H 、O 、 Na 、 K
(2)B2-的电子式为[ S ]2― ,D原子的结构示意图为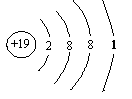
C+离子的结构示意图为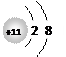
(3)H2O NH3 CH4 HF Ne
