金属在生产生活中应用广泛。
(1)用金属铜做电线,主要利用了金属的_____性。
(2)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)炼铁,反应的化学方程式为_____。
每年因腐蚀而报废了大量的铁制品,铁生锈的条件是_____。
(3)取某溶液少许放入试管中,向其中加入适量的铁粉,充分反应后,向试管中继续加入足量的另一种金属,溶液中FeSO4的质量随时间的
变化如右图所示。试分析:
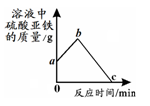
①若b点表示的溶液中只含一种溶质,则a点表示的溶液中的溶质可能是_____(写出1种情况即可),从a点到b点的过程中,反应的化学方程式是_____。
②若从b点到c点的过程中,溶液的质量不断增加,则加入的另一种金属是_____。
(1)导电
(2)Fe2O3 + 3CO 2Fe + 3CO2 与潮湿的空气接触
2Fe + 3CO2 与潮湿的空气接触
(3)① FeSO4和H2SO4(或FeSO4和CuSO4或FeSO4、CuSO4和H2SO4)
Fe + H2SO4 = FeSO4 + H2↑(与上空对应即可)
② Zn
分析:(1)可以用作导线的物质要具有良好的导电性
(2)根据工业炼铁的原理解答.铁与氧气和水充分接触时容易生锈,水和氧气同时存在是铁生锈的必要条件;如果缺少水或缺少氧气,或者缺少氧气和水,铁就不容易生锈.
(3)①起点说明原溶液中含有一定质量的硫酸亚铁,加入铁后能生成硫酸亚铁,使其质量增加②从图中可以看出硫酸亚铁质量减少说明硫酸亚铁发生反应,能与其反应的一定是排在铁前的金属,而溶液的质量不断增加,说明在此化学反应的方程式中反应的该金属质量大于生成的铁的质量.
解答:解:(1)铜具有良好的导电性,可以用铜作导线导电;故答案为:导电
(2)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,故答案为:3CO+Fe2O3 2Fe+3CO2.铁生锈是铁和氧气、水等物质相互作用的结果.故答案为:3CO+Fe2O3
2Fe+3CO2.铁生锈是铁和氧气、水等物质相互作用的结果.故答案为:3CO+Fe2O3 2Fe+3CO2;锈蚀与空气中的氧气与水有关
2Fe+3CO2;锈蚀与空气中的氧气与水有关
(3)①起点说明原溶液中含有一定质量的硫酸亚铁,加入铁后能反应生成硫酸亚铁,使其质量增加,故原溶液中除了溶质硫酸亚铁之外还含有一种能于铁反应生成硫酸亚铁的物质;故可能是硫酸也可能是硫酸铜或兼而有之;故答案为:FeSO4和H2SO4(或FeSO4和CuSO4或FeSO4、CuSO4和H2SO4);Fe+H2SO4=FeSO4+H2↑
②从图中可以看出硫酸亚铁质量减少说明硫酸亚铁发生反应,能与其反应的一定是排在铁前的金属,而溶液的质量不断增加,说明在此化学反应的方程式中反应的该金属质量大于生成的铁的质量;故答案为:Zn
