问题
填空题
在托盘天平的两边各放一只等质量的烧杯,向两只烧杯中分别注入相同质量、相同质量分数的盐酸和稀硫酸,天平平衡。
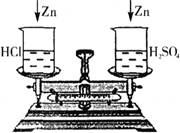
(1)若向两烧杯中分别投入等质量的锌粒(如下图所示),待充分反应后,发现两烧杯中锌粒均有剩余,则天平指针 偏转。(填不或向右、向左)
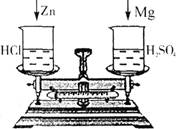
(2)若向左边烧杯中投入少量的锌粒,向右边烧杯中投入等质量的镁条(如下图所示),待充分反应后,发现锌粒和镁条全部溶解,则天平指针 偏转。(填不或向右、向左)
答案
(1)不 (2)向左
分析:反应物放在一起不反应的状态时,天平是平衡的,指针的偏转主要是看生成氢气的多少,因此解题时判断氢气多少则成为解题的关键所在.
解:(1)相同质量的锌粒,锌粒都完全溶解,应根据金属锌的质量进行计算;
此题中虽没有说明反应时金属的质量,根据化学方程式
Zn+H2SO4═ZnSO4+H2↑
65 2
Zn+2HCl═ZnCl2+H2↑
65 2
由于同质量的锌反应生成的氢气相等,故反应后天平保持平衡;
(2)锌粒和镁条全部溶解,说明酸足量,设金属的质量为65,镁生成的氢气质量为y
Zn+2HCl═ZnCl2+H2↑
65 2
Mg+H2SO4═MgSO4+H2↑
24 2
65 y
y=5.4
镁生成的氢气多,指针偏左.
故答案为:(1)指针不偏转(2)指针偏左
点评:本题考查了金属与酸反应生成氢气质量的关系,完成此题,可以依据反应的化学方程式,从酸的质量和金属的质量的角度进行.
