Ⅰ.小明设计了下图1所示的实验装置,进行一氧化碳还原氧化铜的实验。试回答:
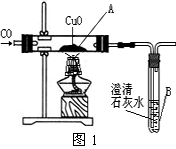
(1)该装置的不足之处是 。
(2)实验开始时,先要进行的操作是 (选填序号:①加热 ②通一氧化碳)。
(3)实验过程中,B处反应的化学方程式是 。
Ⅱ.为分离A装置中反应排出的一氧化碳和二氧化碳,小明又设计了下图2所示的装置(铁架台、铁夹等固定用装置已略去,a、b为活塞)。
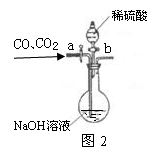
(1)当关闭活塞b,打开活塞a时,可分离得到 (写化学式,下同)。
(2)然后关闭活塞a,再打开活塞b,又可分离得到 。
Ⅲ.对于A装置中反应后得到的红色固体(此时氧化铜已全部反应完),小明进行了以下探究。
【查阅资料】
①氧化铜经一氧化碳还原不仅能生成铜,还可能生成中间产物氧化亚铜(化学式为Cu2O)。
②Cu2O是不溶于水的红色固体,在酸性溶液中,可发生反应生成Cu2+和Cu。
【提出猜想】氧化铜经一氧化碳还原所得到的红色固体中除Cu外还可能含有Cu2O。
【进行实验】小明设计了一个最简单的实验方案。

Ⅰ.
(1)缺少尾气处理装置
(2)②
(3)CO2+Ca(OH)2===CaCO3↓+H2O
Ⅱ.
(1)CO
(2)CO2
Ⅲ.
实验步骤:取少量该红色固体放入盛有稀硫酸(或稀盐酸)的试管中,振荡。
实验现象与结论:若溶液变蓝色,说明产物中有Cu2O;若溶液仍为无色,说明产物中无Cu2O
化学方程式:Cu2O+H2SO4 ===CuSO4+Cu+H2O(或Cu2O+2HCl ===CuCl2+Cu+H2O)
