鸡蛋壳的主要成分是碳酸钙。小明同学为了测定鸡蛋壳中碳酸钙的质量分数,分别设计了如下实验并进行计算。

【实验准备】小明选取合适的仪器组装了如图装置。
(1)小明认为装药品前必须先进行的操作是 ;
(2)如果用该图装置制取气体,反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭的原因是 。
【实验探究】将鸡蛋壳洗净、干燥并捣碎后放入锥形瓶里,加入足量的稀盐酸充分反应(假设其他杂质不与盐酸反应)。测得相关数据如图所示:
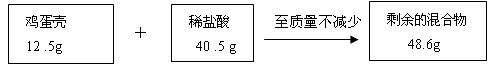
【数据处理】(3)根据质量守恒定律,反应生成二氧化碳的质量为 g 。
(4)请帮小明计算鸡蛋壳中碳酸钙的质量分数,并写出计算过程:
【反思与评价】(5)实验过程如果有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比______________(填“偏大”、 “偏小”或“不变”)。
【实验准备】(1)检查装置气密性
(2)长颈漏斗下端管口无液封,气体从长颈漏斗逸出。
【数据处理】(3)4.4g
(4)解:设该鸡蛋壳中碳酸钙的质量为x 。
CaCO3 +2HCl===CaCl2 + CO2↑+ H2O
100 44
x 4.4 g
解得x=10 g
鸡蛋壳中碳酸钙的质量分数:(10 g ÷ 12.5 g )×100% = 80 %
答:鸡蛋壳中碳酸钙的质量分数是80 % 。
(5)【反思与评价】 偏小
