某纯碱样品中含有少量氯化钠,现欲测定其碳酸钠的质量分数,进行如下实验:
【实验原理】Na2CO3+H2SO4===Na2SO4 + H2O + CO2↑ 通过实验测定反应产生的二氧化碳的质量,即可求得原样品中碳酸钠的质量,进而求得碳酸钠在样品中的质量分数。
【实验装置】
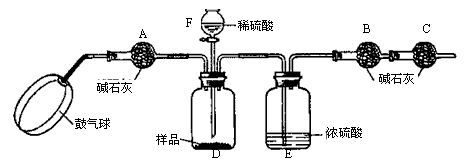
【实验步骤】
①如图连接装置(除B、C外)并加入所需药品。
②称量并记录B的质量(m1)。(称量时注意封闭B的两端。)
⑧按动鼓气球,持续约1分钟。
④连接上B、C。
⑤打开分液漏斗F的活塞,将稀硫酸快速加入D中后,关闭活塞。
⑥按动鼓气球,持续约1分钟。
⑦称量并记录B的质量(m2)。(称量时注意封闭B的两端及E右端的出口。)
⑧计算。
⑴已知碱石灰的主要成分是氧化钙和氢氧化钠,则干燥管A的作用: ;
干燥管C的作用是 ;
E装置的作用是 。
步骤③中鼓气的目的是 ;
步骤⑥中鼓气的目的是 ;
本实验能否同时省略③、⑥两个步骤? ,原因是 。
⑵若所取样品的质量为5g,为确保实验顺利进行,分液漏斗F中至少要盛放10%的稀硫酸(密度为1.07g/mL) mL,若m1为51.20g,m2为53.18g,样品中碳酸钠的质量分数为 。
⑴除去鼓入空气中的二氧化碳;
防止空气中的二氧化碳和水进入B中影响实验结果;
防止D中的水蒸气进入B中;
用除去二氧化碳的空气赶走体系中的二氧化碳;
用除去二氧化碳的空气将反应产生的二氧化碳全部赶入B中;
不能 ,①空气中含少量二氧化碳、②反应后装置中残留二氧化碳均会造成结论偏差。
⑵ 43.4 ;95.4%
