问题
选择题
a、b、c、d是四种短周期元素。a、b、d同周期,c、d同主族。a的原子结构示意图为
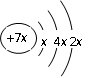 , b与c形成化合物的电子式为
, b与c形成化合物的电子式为 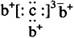 。下列比较中正确的是( )
。下列比较中正确的是( )
A.原子半径:a>c>d>b
B.电负性a>b>d>c
C.原子序数:d>a>c>b
D.最高价含氧酸的酸性c>d>a
答案
答案:D
从a的原子结构示意图可知,a的核外电子排到了第三层,前两层必定为2、8个电子,也就是x=2,所以a为14号元素硅,在第三周期。从电子式看出c原子核外排满8电子后为-3价,所以c是第五主族元素,且不与a对应的硅元素同周期,c应为第二周期第五主族元素N,与c同族的d应为第三周期第五主族的元素P。从电子式还看出,b元素为正一价,应为第一主族元素,且是第三周期,为Na。四个元素在周期表中的位置如下图:
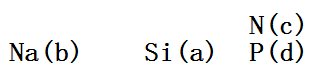
A. 原子半径比较,原子电子层数越多半径越大,电子层数相同时,原子序数越大,半径越小,正确顺序应为b>a>d>c
B. 元素的非金属性越强,电负性越大,一般非金属元素的电负性强于金属元素。非金属性同周期从左到右越来越强,同主族越往上越强,正确电负性顺序为c>d>a>b
C. 原子序数正确顺序为 d>a>b>c
D. 最高价含氧酸的酸性与元素的非金属性正正比,所以c>d>a顺序正确。
