(10分)A、B、C、D、E原子序数依次递增的五种短周期元素,已知:
①B原子核外电子总数与最外层电子数之比为4:3
②D原子最外层电子数与次外层电子数之比为3:4
③E-,C+,A+的离子半径逐渐减小
④A单质在E单质中燃烧火焰呈苍白色
请回答下列问题:
(1)E的最高价氧化物对应水化物的化学式为:___________。它的酸性比D的最高价氧化物对应水化物的酸性:____________。(填“强”或“弱”)
(2)X、Y是由上述元素中任意3种组成的强电解质,且构成的原子个数比均为1:1:1。已知X溶液中水电离出来的C(H+)=10-12mol/L,则X的电子式为:_____________;Y的水溶液酸碱性与X相同,则其原因是(写离子方程式):_______________________________;
(3)B与C构成原子个数比为1:1的化合物与H2O反应的化学方程式为:__________________________________________;
(4)A与B,A与D均可形成18个电子的分子,这两种分子在水溶液中反应生成物之一是含10电子的化合物;该反应可观察到现象是:____________________________________,原因是(用化学方程式表示)_______________________________________________。
(1)HClO4 强 (2)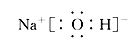 ClO-+H2O
ClO-+H2O HClO+OH-
HClO+OH-
(3)2Na2O2+2H2O=4NaOH+O2↑ (4)淡黄色沉淀 H2S+H2O2=S↓+2H2O
由①知B只能为氧元素,由②知D只能为硫元素,结合③各离子所带电荷综合考虑E、C只能为氯及钠,再由④可判定A为氢元素
(1)氯的最高价氧化物对应水化物为高氯酸HClO4,它是最强的含氧酸,大于硫酸的酸性
(2)X溶液中水电离出来的C(H+)=10-12mol/L,水的电离受抑制,故X可能为强碱或强酸,结合原子个数比可知X为NaOH,其电子式为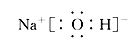 ;
;
同样呈碱性的只能是NaClO,水解呈碱性:ClO—+H2O HClO+OH—
HClO+OH—
(3)Na2O2可与水发生自身氧化还原反应:2Na2O2+2H2O=4NaOH+O2↑
(4)A与B,A与D均可形成18个电子的分子分别为H2O2、H2S,两者可发生氧化还原反应:H2S+H2O2=S↓+2H2O,有浅黄色沉淀生成
