问题
选择题
(2分)(2012•昭通)将盛有等质量、等溶质质量分数的稀硫酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的铁和锌,待反应停止后(不考虑反应中水分挥发,不考虑空气成分参加反应),请判断,下列说法合理的是( )
A.若天平仍保持平衡,烧杯中的铁一定没有剩余
B.若天平失去平衡,指针一定偏向放锌的一边
C.反应后两只烧杯中溶液的质量都比反应前的溶液质量减轻了
D.放铁的一边产生的氢气一定比放锌的一边产生的氢气多
答案
答案:B
A、若天平平衡,说明硫酸不足,全部参加反应;
设金属的质量为1g
Fe+H2SO4═FeSO4+H2↑
56 2
1g 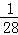 g
g
Zn+H2SO4═ZnSO4+H2↑
65 2
1g 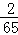 g
g
根据计算可以知道,等质量的硫酸消耗的锌粉的质量要多,所以铁粉可能有剩余,故A说法错误;
B、若天平失去平衡,说明酸过量,金属全部参加反应;可以看出相同质量的锌和铁与足量的硫酸反应,铁生成的氢气质量比锌多,故天平会指向加锌的一方,故B说法正确;
C、根据A可以看出,参加反应的金属的质量大于生成氢气的质量,故反应后两只烧杯中溶液的质量都比反应前的溶液质量增加,故C说法错误;
D根据A分析可知:若酸不足,生成的氢气的质量相等,所以放铁的一边不一定比放锌的一边生成的氢气多,故D说法错误;
故选B.
