(10分)现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 基态原子核外电子共占据5个原子轨道且有2个未成对电子, |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2) 元素Z与元素T相比,非金属性较强的是________(用元素符号表示),
(3)下列表述中能证明“元素Z与元素T相比,非金属性较强的”这一事实的是________。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)元素X和元素Y的第一电离能的大小关系为_________,请说明理由_______________。
(5)CO和Y2是等电子体,CO和Y2的结构均可表示为A≡B的形式(A、B可表示相同元素的原子也可表示不同元素的原子)。下表是两者的键能数据:(单位:kJ/mol)
| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| Y2 | 154.8 | 418.4 | 941.7 |
(1)6(2分) (2) Cl(1分) (3) b(1分)
(4)N>O(1分) N原子的外围电子排布式为2s2sp3,2p轨道处于半充满状态,处于能量较低的稳定状态。(2分)
(5)断裂CO中第一个π键的键能是273kJ/mol,断裂N2中第一个π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。(3分)
T元素M层上有2对成对电子,则T元素的核外电子排布式为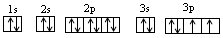 即T元素为S(硫)元素;
即T元素为S(硫)元素;
X元素的基态原子核外电子共占据5个原子轨道且有2个未成对电子,则X元素原子的核外电子数=5×2-2=8,即X元素为O(氧)元素;
Y元素常温下单质为双原子分子,其氢化物水溶液呈碱性,则Y元素为N(氮)元素;
Z元素最高正价是+7价,在短周期中只能是CL(氯)元素;
所以(1)元素T的原子最外层共有6种不同运动状态的电子;
(2)元素Z与元素T为同一周期元素,在同周期中从左至右,元素的非金属性增强,所以非金属性强的为CL;
(3)非金属性强弱的比较依据有:单质与氢气化合的难易、氢化物的稳定性、最高价氧化物对应的水化物—酸性强弱,所以正确选项为b。
(4)N>O 因为N原子的外围电子排布式为2s2sp3,2p轨道处于半充满状态,处于能量较低的稳定状态。
(5)断裂CO中第一个π键的键能是273kJ/mol,断裂N2中第一个π键的键能是523.3kJ/mol,所以CO的第一个键比N2更容易断。
