(12分)现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 原子的电子排布图为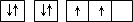 |
| B | 常温下单质为双原子分子,原子间形成三对共用电子对 |
| C | 原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D | 二价阳离子与C的阴离子具有相同的电子层结构 |
| E | 原子序数是D两倍, |
(1)A、B、C的电负性由小到大的顺序为 ;
(2)B的氢化物的分子空间构型是 ,该氢化物的等电子体是 ;
(3)E的价电子排布式是 ,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为 ;
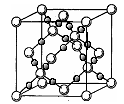
(4)AC2在高温高压下所形成的晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为 ;
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
(1)C<N<O
(2)三角锥形 H3O+
(3)3d54s1 [Cr(NH3)4(H2O)2]Cl3
(4)原子 sp3
(5)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量
由题意可知,A、B、C、D、E对应的元素分别为:C、N、O、Mg、Cr五种元素;
(1)A、B、C的电负性由小到大的顺序为:C<N<O;理由是同周期从左至右,电负性逐渐增大;
(2)B的氢化物的分子为NH3,其空间结构为三角锥形;其等电子体是H3O+;
(3)Cr的价电子排布式是:3d54s1;在CrCl3中Cr元素的化合价为+3价,其价电子排布式为:3d4,有6个空轨道(3d有2个空轨道,4s有一个空轨道,4p有三个空轨道)所以配合物的化学式为[Cr(NH3)4(H2O)2]Cl3;
(4)由图可知该晶体的结构为空间网状结构,晶体属于原子晶体,该晶体中A原子的杂化形式为sp3:
(5)电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量
