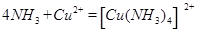问题
填空题
(9分)下表为周期表的一部分,其中的编号代表对应的元素。

(1)写出上表中的元素⑩原子的外围电子排布式 。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为 杂化,元素⑦与⑧形成的化合物的晶体类型是 。
(3)元素④的第一离能 元素⑤(填“>”、“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为 。
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是 。
(5)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为
答案
(9分)(1)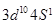 。(1分)
。(1分)
(2)SP2、离子晶体
(3)>、三角锥形
(4)HF分子间易形成氢键,气态HF中存在
(5)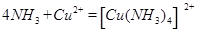
考查元素周期表及元素周期律的知识
(1)元素⑩为铜,为ds区域元素,外围电子排布式为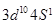
(2)元素③与①形成的水果催熟剂气体化合物为乙烯,碳原子为sp2杂化;元素⑦与⑧形成的化合物为氯化镁,由活泼金属与非金属通过电子的得失形成,为离子化合物
(3)由于N元素的核外电子的半充满结构,第一电离能N相对较大;X为氨气,分子结构为三角锥形
(4)①与⑥形成化合物为HF,由于分子之间易形成氢键,缔合为大分子 ,故实测的相对分子质量一般高于理论值
,故实测的相对分子质量一般高于理论值
(5)将过量氨气通入硫酸铜溶液中可形成铜氨络离子: