(8分) 某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图实验,并对溶液A和固体B的成分进行了分析和研究。
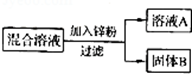
【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】①只有Zn(NO3)2 ②Zn(NO3)2、AgNO3
③Zn(NO3)2、Cu(NO3)2 ④Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是 (填标号),其理由是
。
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现象 | 结论 |
| 取少量固体B,滴 加 (填试剂名称) | 有气泡产生 | 固体B的成分为 。 有关反应的化学方程式: 。 |
(8分) 【交流讨论】② , 猜想②中无硝酸铜,说明Cu(NO3)2已与锌反应生成Cu,而铜能与硝酸银反应,所以不可能存在硝酸银。(2分)
【实验探究】稀盐酸 Zn、Cu、Ag(2分) Zn+2HCl═ZnCl2+H2↑ (2分)
题目分析:向AgNO3和Cu(NO3)2混合溶液中加入一定量的锌粉,因锌的活动性强与铜和银,而铜的活动性强于银,则锌将置换AgNO3中的银,也会置换Cu(NO3)2中的铜,而铜又将置换AgNO3中的银。
1、若锌是适量或过量的的,则反应后,溶液A中只有Zn(NO3)2;若锌较少,只反应了AgNO3,则溶液A中有Zn(NO3)2、Cu(NO3)2;若锌太少,则溶液A中有 Zn(NO3)2、Cu(NO3)2、AgNO3;题中②的猜想是不合理的,因为猜想②中无硝酸铜,说明Cu(NO3)2已与锌反应生成Cu,而铜能与硝酸银反应,所以不可能存在硝酸银。
2、若猜想①成立,则锌可能是恰好反应,也可能是过量,有剩余。则:取少量固体B,滴
加稀盐酸,若有气泡产生,则锌是过量的,固体B的成分为Zn、Cu、Ag,因Cu、Ag的活动性弱于H,故有关的化学方程式为:Zn+2HCl═ZnCl2+H2↑ 。
点评:本题设计反应物是否过量的问题,需分开讨论其结果,难度较大。
