(6分)回答以下问题:
⑴应用金属活动性顺序能帮助我们进一步学习金属性质。已知下列各组物质间均能发生置换反应。
A.Fe 和CuSO4溶液 B.Mg和MnSO4溶液 C.Mn和FeSO4溶液
①写出Fe 和CuSO4溶液反应的化学方程式 。
②在相同条件下,四种金属中能与盐酸反应且最剧烈的是 。
⑵氯化铁能腐蚀铜,工业上常用此原理生产印刷线路板。印刷线路板的生产及废液的处理过程如下:
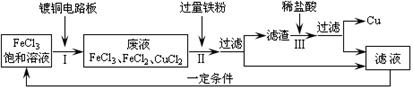
①步骤Ⅱ中发生了两个反应:Fe + 2FeCl3 = 3FeCl2和Fe + CuCl2 = FeCl2 + Cu。滤渣的成分是 ,滤液中的溶质是 。
②步骤Ⅲ中发生反应的化学方程式为 。
③氯化铁能腐蚀铜的原因是(用化学方程式表示) 。
⑴ ① Fe + CuSO4 FeSO4 + Cu ② Mg
⑵ ① Fe和Cu FeCl2
② Fe + 2HCl FeCl2 + H2↑
③ Cu + 2FeCl3 2FeCl2 + CuCl2
题目分析:(1)①铁的活动性比铜强,可与硫酸铜溶液反应生成铜和硫酸亚铁,故化学方程式为Fe+CuSO4═FeSO4+Cu;
②由Fe能和CuSO4溶液反应,得铁比铜强;由Mg能和MnSO4溶液反应,得镁比锰强;由Mn和FeSO4溶液反应,得锰比铁强,故四种金属活动性由强至弱的顺序Mg>Mn>Fe>Cu,则四种金属中能与盐酸反应且最剧烈的金属为Mg。
(2)①向FeCl3、FeCl2、CuCl2的混合溶液中加入过量铁粉,铁粉与FeCl3反应生成FeCl2、与CuCl2反应生成Cu和FeCl2,因此可知过滤所得滤渣中含有剩余的Fe和生成的Cu,滤液中含FeCl2;
②向含有Fe和Cu的滤渣中加入稀盐酸,铁与盐酸反应生成FeCl2和H2,故反应的化学方程式为Fe+2HCl═FeCl2+H2↑;
③印刷线路板的生产中所得废液中含FeCl3、FeCl2、CuCl2,可推断氯化铁能腐蚀铜生成FeCl2与CuCl2,故反应的化学方程式为Cu+2FeCl3 2FeCl2+CuCl2。
点评:熟记金属活动性顺序及其应用,在金属活动性顺序中,位于氢之前的金属能从酸中置换出氢,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来。
