(11分)图表法、图象法是常用的科学研究方法。阅读下列图表回答问题:
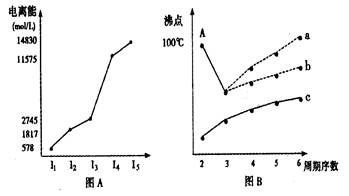
(1)第三周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的_____族,根据同周期元素第一电离能的变化规律,推断在M元素所在周期的所有元素中,M元素的第一电离能的大小(最小)范围为______<M<________(填元素符号)。
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第_______族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:______(填“a”或“b”),请说明A点代表的的氢化物的沸点较高的原因_____________________________________________。
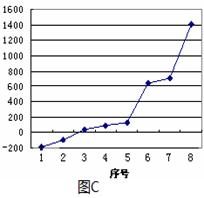
(3) 图C是表示表示第三周期8种元素单质的熔点(℃)折线图,已知序号“1”对应的点代表Ar,其中序号“8”代表 _______(填元素符号);其中电负性最大的是_________(填图C中的序号)。
(1)IIIA (1分) Na <M<Mg (2分)
(2)IVA (1分); b(1分); a点所示的氢化物是水,由于在水分子间存在氢键,同族其它元素的氢化物只存在范德华力,所以水的沸点较高。 (2分)
(3) Si(2分). 2(2分)
(1)由图可知,该元素的第三电离能与第四电离能数值上有一大的跨度,即该元素的最外层有三个电子,为IIIA族元素,也就是铝元素;
同周期元素随核电荷数的递增,第一电离能逐渐增大,但由于镁元素的最外层电子的全充满状态,使其第一电离能略大于铝,故铝元素的第一电离能大小范围为: Na <Al<Mg
(2)常见的氨、水、HF中均有氢键,沸点反常,故折线c可以表达第IVA族元素氢化物的沸点的变化规律;
A点物质的沸点为100℃,故为水,它的分子间存有氢键,它的沸点高于同族其它元素的氢化物沸点(只存在范德华力),故折线b正确
(3)第三周期元素单质中硅为原子晶体,它的熔点最高,其中序号“8”代表硅
同周期中,氯的电负性最大,而除氩外,只有氯气在常温下为气体,它的熔点仅高于氩,即为“2”
