问题
选择题
质量相同的下列金属,分别加入到足量的稀盐酸中充分反应,放出氢气最多的是( )
A.Mg
B.Al
C.Cu
D.Zn
答案
答案:B
题目分析:根据题意书写各金属与稀盐酸反应的化学方程式,再利用各金属与氢气的质量比,计算出相同质量的各金属(可均取1g)分别与足量稀盐酸反应生成的氢气的质量,最后进行比较即可。
A、Mg+H2SO4=MgSO4+H2↑
24 2
1g x
24:2=1g:x
解得x=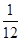 g
g
即1g镁生成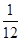 克氢气;
克氢气;
B、2Al+3H2SO4= Al2(SO4)3+3H2↑
54 6
1g y
54:6=1g:y
解得y= 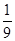 g
g
即1g铝生成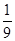 克氢气;
克氢气;
C、由于铜的活动性排在氢的后面,故不能与盐酸反应生成氢气,即气体为0;
D、Zn+H2SO4= ZnSO4+H2↑
65 2
1g z
65:2=1g:z
解得z=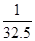 g
g
即1g锌生成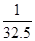 克氢气。由此可判断,质量相同的金属,与足量的稀盐酸充分反应后,放出氢气最多的是Al。故选B
克氢气。由此可判断,质量相同的金属,与足量的稀盐酸充分反应后,放出氢气最多的是Al。故选B
点评:熟练掌握金属与酸反应的化学方程式,并能灵活应用金属与氢气间的固定质量比进行计算,是解答本题的关键。
