(16分)短周期六元素A、B、C、D、E、F,原子序数依次增大;A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,A原子核外有2个未成对电子,C单质可与热水反应但不能与冷水反应;E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,F能与A形成相同价态的阴离子,且A离子半径小于F离子。回答:
(1)写出各元素的符号:A B C D E F
(2)写出B与C形成的化合物的电子式
(3)请写出元素F的价电子排布式
(4)上述六种元素按电负性从小到大的排列是 (写元素符号)。
(5)C、D、E、F元素第一电离能最大的是 (写元素符号);
(6)C、D、E、F四种元素中,形成的最高价氧化物对应水化物中(写化学式):
酸性最强的是 碱性最强的是 呈两性的是
(1)写出各元素的符号:A O B F C Mg D Al E P F S
(2)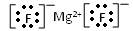
(3)元素F的价电子排布式3s23p4
(4)上述六种元素按电负性从小到大的排列是 Mg<Al<P<S<O<F(写元素符号)。
(5)第一电离能最大的是 P (写元素符号);
(6)酸性最强的是 H2SO4 碱性最强的是 Mg(OH)2 呈两性的是 Al(OH)3
考查原子结构、电子排布及元素周期律的相关知识
A、B的阴离子与C、D的阳离子的电子排布式均为ls22s22p6,说明A、B为第二周期右端非金属元素,而CD为第三周期左端金属元素;
A原子核外有2个未成对电子,可能为碳元素:ls22s22p2或氧元素:ls22s22p4,由于碳不能形成简单离子,排除,故A为氧元素,B只能为氟元素;
第三周期可形成简单阳离子的元素只有钠、镁和铝三种元素,而C单质可与热水反应但不能与冷水反应,说明C只能为镁,而D只能为铝;
E、F原子在基态时填充电子的轨道有9个,且E原子核外有3个未成对电子,则E为磷元素:ls22s22p43s23p3,而F能与A形成相同价态的阴离子,且A离子半径小于F离子,说明F是与氧同主族的硫元素
(2)两元素形成离子化合物: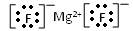
(3)硫元素的最外层电子为价电子,即3s23p4
(4)一般来讲,非金属性越强,电负性越强,同周期自左向右,非金属性增强,故电负性:Mg<Al<P<S、O<F,而同主族,自下而上非金属性增强,故S<O,总之:Mg<Al<P<S<O<F
(5)同周期,随核电荷数的增加,第一电离能越来越大,但由于P元素的半充满结构影响,导致P的第一电离能最大
